PÁGINA 2 |
 |
|

primario, tiene una composición multidisciplinaria y balanceada en edad, sexo y formación científica y no científica. Posee un número adecuado de miembros, con al menos cinco miembros titulares y dos alternos. El miembro alterno tiene las mismas responsabilidades que el titular, y tiene derecho a voto cuando lo reemplaza por ausencia.
Todo estudio de investigación debe ser evaluado por un CEI antes de su inicio y luego en forma periódica hasta su finalización. El Comité tiene autoridad para aprobar, solicitar modificaciones, desaprobar, interrumpir o cancelar una investigación en salud humana. Recientemente, en agosto de 2015, entró en vigencia el nuevo Código Civil y Comercial de la Nación que establece en el artículo 58 “Investigaciones en seres humanos” inciso c, que la investigación sólo puede ser realizada si “cuenta con la aprobación previa de un comité acreditado de evaluación de ética en la investigación”.
Es responsabilidad del CEI evaluar si los investigadores son idóneos por su formación profesional, analizando antecedentes académicos, trabajos publicados, capacitación en aspectos éticos y normativos para la conducción del estudio; y si el centro en el que se conducirá el estudio tiene la infraestructura adecuada para la realización de la investigación.
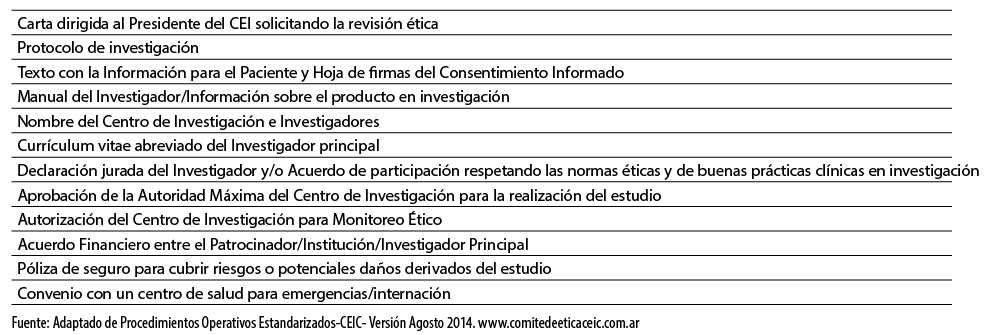
La documentación que requieren los Comités, en términos generales, para la revisión ética de un estudio de investigación se detalla en la tabla 1. Los requerimientos varían de acuerdo al tipo de estudio.
El CEI debe asegurarse que los potenciales participantes darán su consentimiento libre de coerción e incentivo indebido y lo hará luego de recibir toda la información de manera adecuada. Es un requisito ineludible que aquellas personas que se involucren en un estudio lo hagan bajo su propia voluntad. Para garantizar el cumplimiento de este requisito, se adoptó el mecanismo de consentimiento informado. Como lo describe la disposición 6677/10 de la Administración Nacional de Medicamentos, Alimentos y Tecnología Médica (ANMAT), este proceso permite asegurar que un individuo tome de manera voluntaria, libre de incentivos indebidos y de coerción, la decisión de participar en una investigación en salud humana, siempre que ésta sea consistente con sus valores, intereses y preferencias. Así, se asegura el cumplimiento del principio ético de autonomía, que exige el respeto a la capacidad de decisión de las personas, y el derecho a que se respete su voluntad en aquellas cuestiones que se refieren a ellas mismas. El artículo 59 del Código Civil y Comercial de la Nación destaca las consideraciones relacionadas con el consentimiento informado para actos médicos e investigaciones en salud. En la tabla 2, se describen los elementos esenciales de la hoja de información para el paciente.
En la Resolución 1480/2011 del Ministerio de Salud, “Guía para Investigaciones con Seres Humanos”, se describen las excepciones a requisitos específicos del proceso de consentimiento. El CEI podría exceptuar un requisito del proceso de obtención del consentimiento en las siguientes situaciones:
(a) cuando la antelación del consentimiento podría invalidar los resultados de la investigación, por ejemplo, cuando se estudia el comportamiento de un grupo humano. Al ser advertidos, los sujetos
Tabla 1. Documentación necesaria para la revisión ética de un estudio de investigación.
PÁGINA 2 |
 |
|
